
陆军军医大学罗强团队新型纳米机器人,精准阻断PD-L1 + 原位纤维化破坏癌细胞膜,双重激活免疫杀伤。
研究背景
结直肠癌(尤其是pMMR型“冷”肿瘤)对PD-1/PD-L1阻断疗法响应极差,超95%患者无效,主要因肿瘤微环境高度免疫抑制,T细胞难以浸润。传统联合化疗、放疗或光热疗法虽可通过诱导免疫原性细胞死亡(ICD)释放DAMPs,将“冷”瘤转为“热”瘤,但副作用严重(如骨髓抑制、腹泻、免疫相关不良事件)。因此,亟需开发低毒、高特异性的策略:分子靶向精准释放DAMPs + PD-1/PD-L1阻断,成为pMMR型结直肠癌免疫治疗的新方向。
研究内容
本研究设计了一种智能肽-接枝聚合物纳米机器人(NRb),在生理pH下为纳米颗粒,到达肿瘤酸性微环境(pH 6.5)后靶向PD-L1并原位纤维化,形成纤维网络,实现两大功能:① 持久阻断PD-1/PD-L1(肿瘤滞留>120 h),恢复T细胞杀伤;② 机械破坏癌细胞膜,精准诱导ICD,释放DAMPs,促进CD4+/CD8+ T细胞大量浸润。在多种结直肠癌小鼠模型中,疗效显著优于αPD-L1+奥沙利铂联合方案,且靶向性强、生物相容性好,为pMMR型结直肠癌免疫治疗提供临床潜力。
研究结果
Fig. 1:NRb锚定肿瘤细胞并转化,实现PD-1/PD-L1阻断与DAMPs释放。
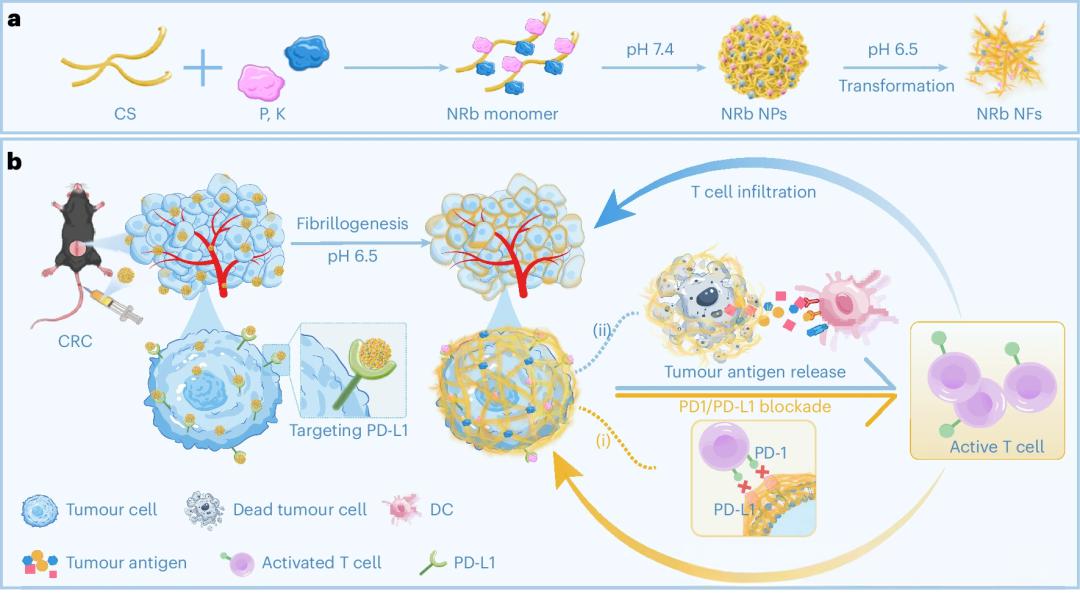
a, NRb的制备示意图,包括肽P(PD-L1靶向序列)、K(pH响应转化单元)和CS单元。NRb在pH 6.5条件下从纳米颗粒(NPs)转化为纳米纤维(NFs)。b, NRb通过结合PD-L1实现肿瘤靶向富集,并在pH 6.5下原位转化,随后(i)实现长期PD-1/PD-L1阻断,恢复T细胞杀伤活性;(ii)通过破坏癌细胞膜释放肿瘤抗原,促进T细胞向肿瘤浸润,从而增强免疫治疗效果。
Fig. 2:NRb的制备及pH诱导转化过程。
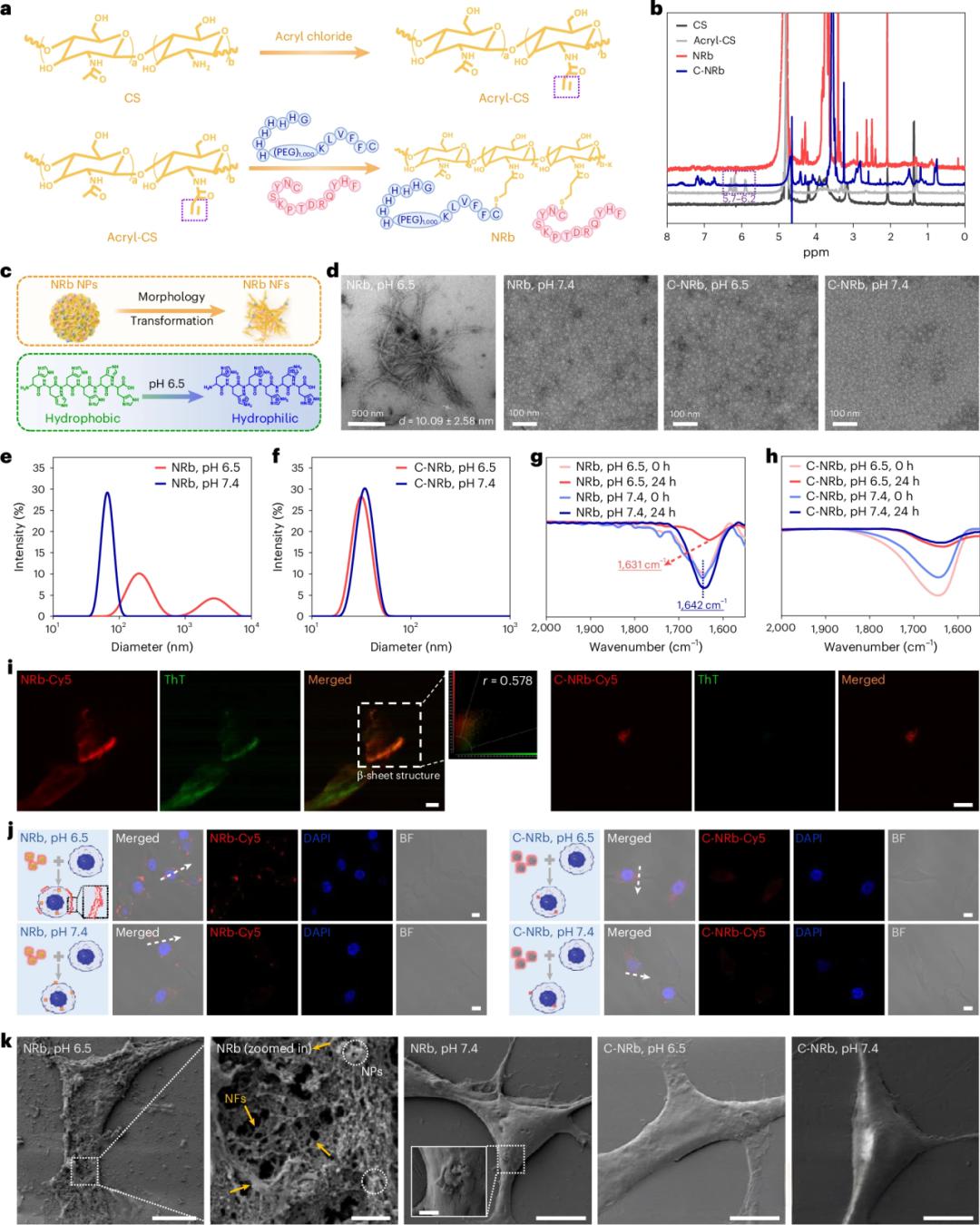
a, 丙烯酰化壳聚糖(acryl-CS)和NRb的合成路线。NRb通过丙烯酰-CS中的烯烃键与K和P中过量的巯基发生Michael加成反应合成,K:P的摩尔比为1:1。对照组C-NRb采用相同方法,由丙烯酰-CS与K′和P′反应制备。b, CS、acryl-CS、NRb和C-NRb在D₂O中的¹H核磁共振谱图。c, 酸性环境下组氨酸质子化诱导NRb纳米颗粒(NPs)转化为纳米纤维(NFs)的示意图。d, NRb(1.0 mg ml⁻¹)和C-NRb(1.0 mg ml⁻¹)分别在pH 6.5和pH 7.4条件下孵育24 h后的透射电子显微镜(TEM)图像。n = 3个独立样品。e,f, NRb(e)和C-NRb(f)在pH 6.5和pH 7.4条件下培养24 h后的粒径分布。g,h, NRb(g)和C-NRb(h)在pH 6.5和pH 7.4条件下0 h和24 h的傅里叶变换红外光谱(FTIR)。i, Cy5标记的NRb和C-NRb与ThT(20 μM,绿色)在pH 6.5条件下孵育24 h后的体视激光共聚焦显微镜(CLSM)图像。比例尺,5 μm。n = 3个独立样品。j, CT26细胞在pH 6.5或pH 7.4条件下与NRb或C-NRb共孵育4 h的示意图及CLSM图像。比例尺,10 μm。n = 3个独立样品。k, CT26细胞分别在pH 6.5或pH 7.4条件下与NRb或C-NRb孵育后的扫描电子显微镜(SEM)图像(n = 3个生物学独立样品)。比例尺,10 μm,1 μm(放大图像)。红色通道:λex = 647 nm,λem = 649–693 nm;绿色通道:λex = 488 nm,λem = 500–550 nm;蓝色通道:λex = 405 nm,λem = 415–465 nm。
Fig. 3:NRb通过原位纤维化行为破坏细胞膜,释放DAMPs。
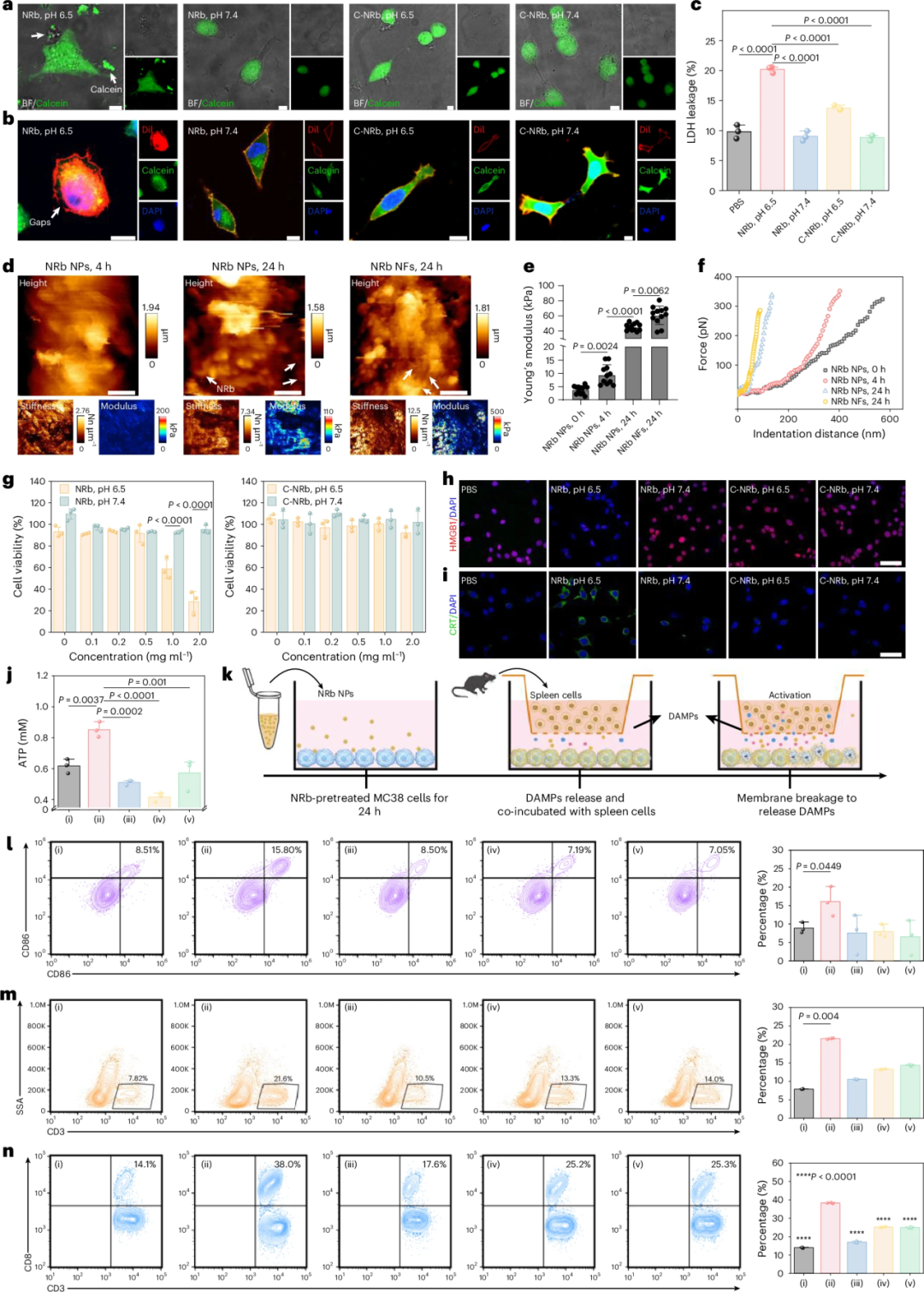
a:CT26细胞先与0.2 μM钙黄绿素(绿色)共孵育0.5 h,再在pH 6.5或pH 7.4条件下用NRb或C-NRb处理24 h后的CLSM图像。比例尺,7.5 µm。n = 3个独立样品。b:同a处理方式,并在处理后用Dil染细胞膜、DAPI染核的CT26细胞CLSM图像。比例尺,10 µm。n = 3个独立样品。c:CT26细胞在PBS、NRb或C-NRb处理(pH 6.5和pH 7.4)后培养基中LDH泄漏量。数据为均值±标准差,n = 3个生物学独立样品。统计采用单因素方差分析+事后Tukey检验。d:CT26细胞与NRb NPs孵育4 h和24 h,以及与NRb NFs孵育24 h(pH 6.5)后的原子力显微镜测得的高度、硬度和杨氏模量图像。比例尺,2 µm。n = 3个独立样品。e:d中CT26细胞杨氏模量的定量统计。数据为均值±标准差,每组n = 12(4 h组n = 11),n = 3个独立样品。统计采用Welch’s ANOVA检验。f:d中CT26细胞的悬臂力-压入距离曲线(以力开始增加为起点)。g:不同浓度NRb(左)和C-NRb(右)在pH 6.5和pH 7.4条件下处理CT26细胞的细胞存活率。数据为均值±标准差,n = 3个独立实验。统计采用单因素方差分析+事后Tukey检验。h,i:pH 6.5条件下NRb处理CT26细胞后HMGB1(h)和CRT(i)的免疫荧光图像。比例尺,50 µm。n = 3个独立样品。j:CT26细胞在PBS(i)、NRb pH 6.5(ii)、NRb pH 7.4(iii)、C-NRb pH 6.5(iv)和C-NRb pH 7.4(v)处理后培养基中释放的ATP量。数据为均值±标准差,n = 3个生物学独立样品。统计采用单因素方差分析+事后Tukey检验。k:体外研究NRb在pH 6.5下释放DAMPs激活T细胞的Transwell模型示意图。l:DC成熟(CD80+CD86+,门控于CD11c+细胞)的代表性流式图及定量分析。数据为均值±标准差,n = 3个生物学独立样品。统计采用单因素方差分析。m:Transwell系统孵育后小鼠脾脏CD3+ T细胞的流式分析图像及定量统计。数据为均值±标准差,n = 3个生物学独立样品。统计采用Kruskal–Wallis检验。n:小鼠脾脏CD8+ T细胞(门控于CD3+细胞)的代表性结果及定量分析((i) PBS;(ii) NRb pH 6.5;(iii) NRb pH 7.4;(iv) C-NRb pH 6.5;(v) C-NRb pH 7.4)。数据为均值±标准差,n = 3个独立实验。P值采用单因素方差分析+事后Tukey检验。红色通道:λex = 555 nm,λem = 570–620 nm;绿色通道:λex = 488 nm,λem = 500–550 nm;蓝色通道:λex = 405 nm,λem = 415–465 nm。
Fig. 5:NRb在MC38异种移植C57BL/6小鼠或CT26肺转移BALB/C小鼠模型中的抗癌效果。
![]()
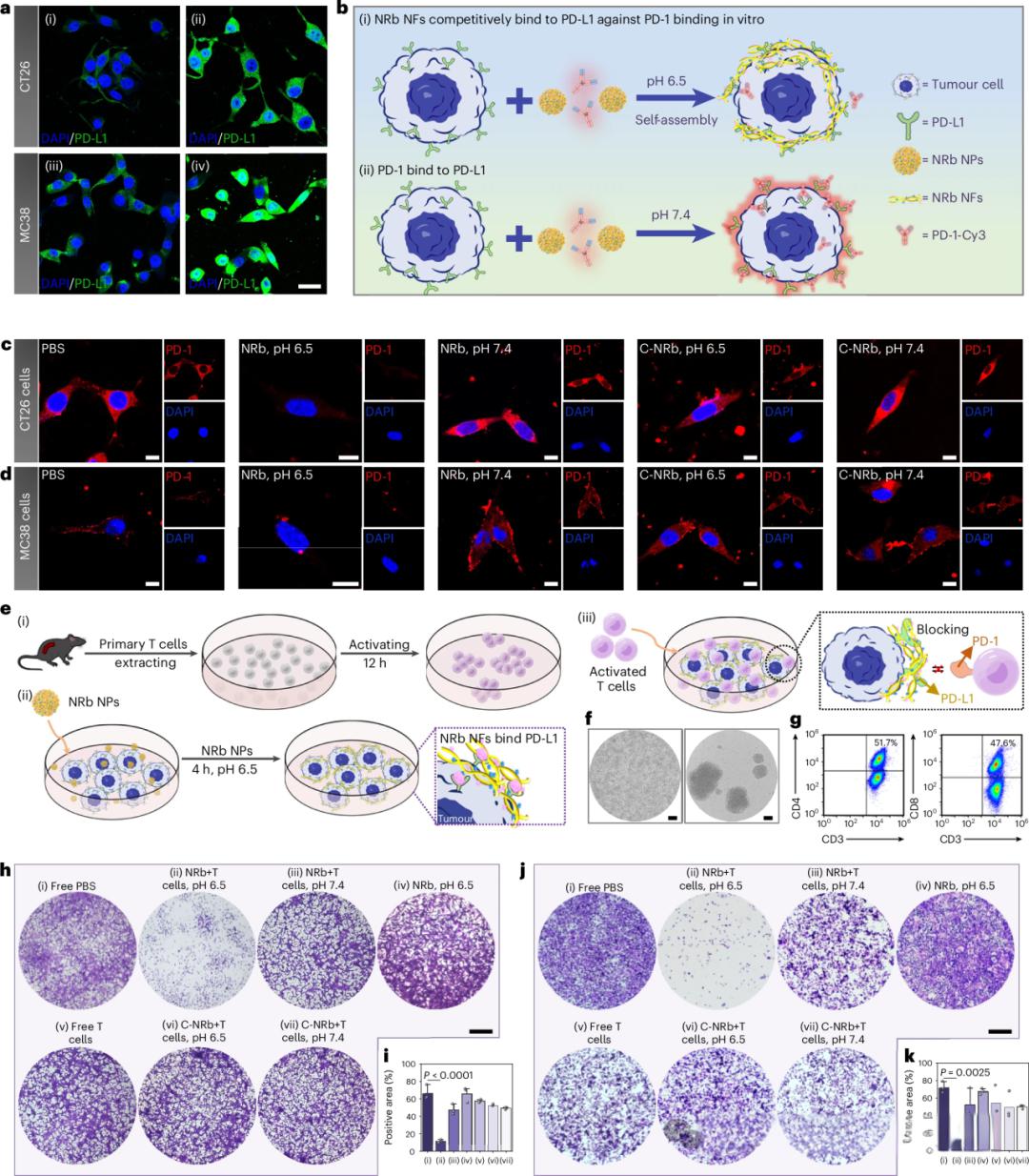
a:MC38荷瘤小鼠模型建立、不同给药方案处理(PBS (i)、NRb+Oxa (ii)、NRb (iii)、C-NRb+Oxa (iv)、C-NRb (v)、αPD-L1+Oxa (vi)、αPD-L1 (vii)、Oxa (viii))及三周观察示意图。b:不同处理组小鼠体重变化。数据为均值±标准差,n = 4只小鼠(C-NRb ± Oxa组及αPD-L1+Oxa组n = 5)。c:不同处理组小鼠肿瘤体积变化。数据为均值±标准差,n = 4只小鼠(C-NRb ± Oxa组及αPD-L1+Oxa组n = 5;PBS、Oxa组n = 3)。统计采用Kruskal–Wallis检验。d:体内评价后各组小鼠离体肿瘤重量。数据为均值±标准差,n = 3只小鼠/组。P值采用单因素方差分析+事后Tukey检验。e:体内评价后各组离体肿瘤代表性图像(n = 3只小鼠/组)。f:不同处理后肿瘤组织中CD8+(绿色)和CD4+(红色)T细胞的代表性免疫荧光图像。比例尺,25 μm。n = 3个独立样品。g,h:肿瘤免疫细胞中CD8+ T细胞(g)和CD4+ T细胞(h)的流式分析(PBS、NRb、C-NRb、αPD-L1处理组)。i,j:肿瘤组织中CD8+(i)和CD4+(j)T细胞百分比(PBS (i)、NRb (ii)、αPD-L1 (iii)、C-NRb (iv)组)。数据为均值±标准差,n = 3个生物学独立样品。统计采用单因素方差分析+事后Tukey检验。k:CT26荷瘤小鼠模型建立、不同给药方案处理及三周观察示意图。l–n:各组小鼠体重(l)、代表性肺组织图像及其苏木精-伊红染色(m)以及肺组织肿瘤转移灶平均数量(n)。比例尺,2 mm。n = 4只小鼠(αPD-L1、αPD-L1+FOLFOX、FOLFOX组n = 3),l和n数据为均值±标准差。统计采用单因素方差分析+事后Tukey检验。红色通道:λex = 555 nm,λem = 570–620 nm;绿色通道:λex = 488 nm,λem = 500–550 nm;蓝色通道:λex = 405 nm,λem = 415–465 nm。Wt,野生型。
Fig. 6:NRb在AOM/DSS诱导的原发肿瘤模型中的抗肿瘤活性。
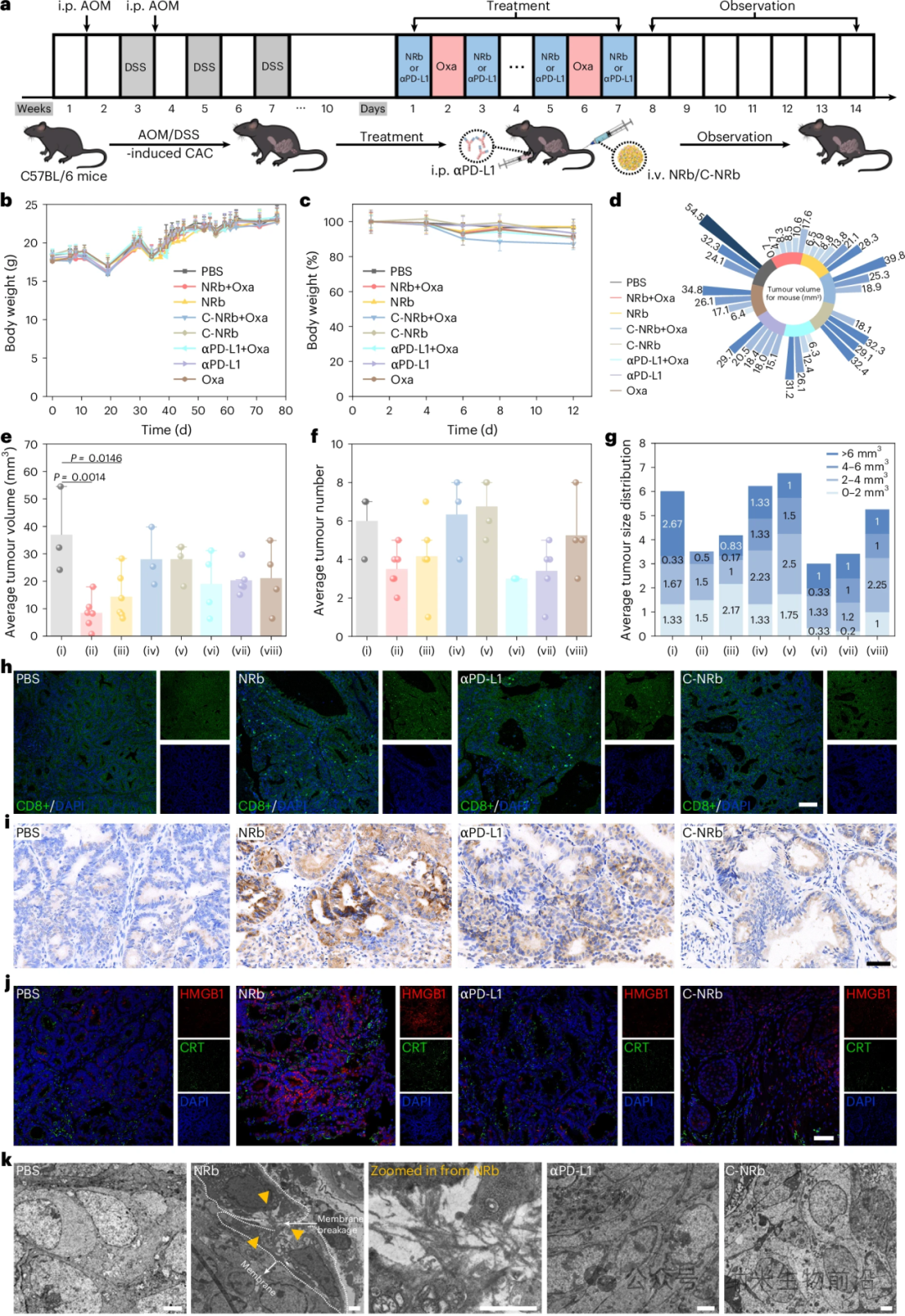
a:AOM/DSS诱导建立结肠炎相关结直肠癌(CAC)模型过程及抗肿瘤治疗示意图;建模70天后,小鼠随机分为8组:PBS (i)、NRb+Oxa (ii)、NRb (iii)、C-NRb+Oxa (iv)、C-NRb (v)、αPD-L1+Oxa (vi)、αPD-L1 (vii)、Oxa (viii)。b:各组小鼠建模期间体重变化趋势。数据为均值±标准差,n = 6只小鼠/组。c–g:各组小鼠体重维持(以第一天体重归一化,c)、每只小鼠肿瘤体积径向柱状图(d)、平均肿瘤体积(e)、平均肿瘤数量(f)以及不同大小肿瘤分布(0–2、2–4、4–6、>6 mm³;g)。n分别为PBS、NRb+Oxa、NRb、C-NRb+Oxa、C-NRb、αPD-L1+Oxa、αPD-L1、Oxa组的3、6、6、3、4、4、5、4只,c、e、f数据为均值±标准差。统计采用单因素方差分析。h:肿瘤切片中CD8+ T细胞免疫荧光染色(n = 3个生物学独立样品)。比例尺,75 μm。i:治疗后肿瘤组织IFN-γ(棕色)的免疫组化分析(n = 3个生物学独立样品)。比例尺,40 μm。j:接受PBS、NRb、αPD-L1或C-NRb注射后肿瘤组织HMGB1(红色)和CRT(绿色)的免疫荧光染色(n = 3个生物学独立实验)。比例尺,50 μm。k:PBS、NRb、αPD-L1及C-NRb处理小鼠肿瘤的生物透射电镜图像,显示NRb组细胞膜破裂(n = 3个生物学独立样品)。比例尺,2 μm。红色通道:λex = 555 nm,λem = 570–620 nm;绿色通道:λex = 488 nm,λem = 500–550 nm;蓝色通道:λex = 405 nm,λem = 415–465 nm。
结论
NRb是一种肿瘤微环境pH触发的“可转化”纳米机器人,在癌细胞表面原位纤维化,机械破坏细胞膜精准诱导ICD并释放DAMPs,同时持久阻断PD-1/PD-L1,显著改善pMMR型结直肠癌的免疫逃逸和T细胞浸润不足问题。单药疗效优于商业αPD-L1,且比传统放化疗+免疫联合方案滞留更久、靶向更强、副作用更少。
小鼠模型中安全有效,但临床转化仍需验证人体抗瘤机制、长期生物降解及更高物种安全性。NRb单药策略为免疫耐药pMMR结直肠癌提供高潜力纳米免疫新路径。
来源:纳米生物前沿
原文链接:https://www.nature.com/articles/s41565-025-02071-3

